Neues und Relevantes aus der Arzneimittel-Welt
Ausgesuchte Informationen der KVB und von anderen seriösen Partnern aus dem Gesundheitswesen über Fertigarzneimittel und Wirkstoffe bzw. Wirkstoffgruppen.
Bitte besonders beachten
Anstieg von Fälschungen bei "rosa Rezepten" - eRezept beugt Fälschungen vor! (KVB-Meldung 27.05.2025)
Medizinalcannabis Kein Genehmigungsvorbehalt für bestimmte Fachgruppen mit bestimmten Zusatz- bzw. Schwerpunktbezeichnungen
Bedenken Sie, dass ohne Vorabgenehmigung die Verantwortung für die Wirtschaftlichkeit einer Verordnung allein beim verordnenden Arzt liegt. Eine sorgfältige Dokumentation aller Voraussetzungen für eine Medizinalcannabisverordnung nach § 31 Absatz 6 SGB V empfiehlt sich deshalb dringend.
Arzneimittel-Verordnungen
Arzneimittel von A-Z
Bitte klicken Sie auf einen Begriff, um zu entsprechenden Arzneimittelinformationen zu gelangen.
Liefer- und Versorgungsengpässe
Gemeinsame Mitteilung KVB-Krankenkassen
Die bayerischen Krankenkassen und die KVB haben sich darauf verständigt, den aktuellen Lieferengpässen bei zahlreichen Arzneimitteln mit einer unbürokratischen Ausnahmeregelung zu begegnen.
Besonders relevante Engpässe
Nach aktueller Prüfung liegt für die oral feste Darreichungsform in der Stärke 70 mg Lieferengpässe für einen Marktanteil ca. 90 Prozent vor.
Der Wirkstoff Alendronsäure wird als versorgungsrelevant klassifiziert und wird zur Therapie der Osteoporose eingesetzt. Die Hauptindikationen sind die postmenopausale Osteoporose und Knochenaufbaustörungen bei Männern.
Alendronsäure gehört chemisch zur Arzneistoffgruppe der Bisphosphonate. Neben Alendronsäure gehören auch Ibandronsäure, Zolendronsäure oder Risedronsäure zur Gruppe der Bisphosphonate, die ebenfalls für die Behandlung der Osteoporose zugelassen sind.
Derzeit werde der Lieferengpass nicht als akut kritisch bewertet, da andere Wirkstoffe, die ebenfalls zur Behandlung der Osteoporose zugelassen sind, verfügbar sind und die Möglichkeit des Einzelimportes aus dem Ausland (§ 73 Absatz 3 AMG) besteht.
Das BfArM informiert über eine kritische Verfügbarkeit von Metronidazol-haltigen Tabletten. Ursache sind nach den vorliegenden Informationen Qualitätsprobleme, die in der Folge zu einer verspäteten Bereitstellung von Neuware führen. Aktuell sind Lieferengpässe für einen Marktanteil von ca. 90% gemeldet. Nach fachlicher Einschätzung ist eine Unterversorgung mit Metronidazol sehr kritisch zu beurteilen.
Die Anhörung nach §52b Abs. 3e AMG der pharmazeutischen Unternehmen, welche Metronidazol-Tabletten in Deutschland vertreiben, hat u. a. ergeben, dass Importe ausländischer Ware zur Kompensation aktuell nicht zur Verfügung stehen. Die Option Arzneimittel als Einzelimport gemäß § 73 Abs. 3 AMG zu beziehen ist nach den dem BfArM übermittelten Angaben gegeben. Nach Information des BfArM wurden in KW 50 Metronidazol-haltige Tabletten des Zulassungsinhabers Aristo Pharma GmbH in der Stärke 400mg (PZN 07521280) in größerem Umfang freigegeben, womit von einer kurzfristigen eintretenden Minimierung der bestehenden Einschränkung auszugehen ist.
Vor diesem Hintergrund empfiehlt das BfArM, die verfügbare Warenmenge bevorzugt in jenen Indikationsgebieten einzusetzen, für die keine oder nur begrenzte therapeutische Alternativen zur Verfügung stehen und Bevorratung zu vermeiden, um mit diesen Maßnahmen die größtmögliche Patientenversorgung zu gewährleisten.
Arzneimitteltherapiesicherheit
Meldung Verdachtsfälle
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bietet eine Online-Datenbank mit Verdachtsmeldungen unerwünschter Arzneimittelwirkungen an. Ärzte und Patienten verfügen damit über eine weitere Möglichkeit, sich über Arzneimittelrisiken zu informieren.
Die Verdachtsfälle beziehen sich auf unerwünschte Ereignisse beim Patienten, die nach der Einnahme von Arzneimitteln eingetreten sind und die dem BfArM mit dem Verdacht auf einen ursächlichen Zusammenhang mit einem bestimmten Arzneimittel gemeldet wurden. Dies bedeutet aber nicht automatisch, dass ein ursächlicher Zusammenhang mit dem Arzneimittel auch tatsächlich existiert.
Die Meldungen sind, zusammen mit weiteren Informationen, Grundlage für die kontinuierliche Überwachung und Verbesserung der Arzneimittelsicherheit durch das BfArM. Signale für neue Risiken, die sich aus den Verdachtsmeldungen ergeben, führen bei Bedarf zu entsprechenden Sicherheitsmaßnahmen.
Die Rechercheergebnisse bedürfen einer medizinischen Interpretation und dürfen keinesfalls als Ersatz für eine ärztliche Aufklärung über mögliche Nebenwirkungen eines Arzneimittels betrachtet werden. Die individuelle Nutzen-Risiko-Bewertung eines Arzneimittels für einen Patienten kann nur im Gespräch mit dem behandelnden Arzt getroffen werden.
Das behördlich genehmigte Schulungsmaterial "Blaue Hand" informiert Ärzte, Apotheker und Patienten über einzelne Arzneimittel und deren sichere Anwendung. Wie die Fachinformation und die Packungsbeilage ist es Bestandteil der Zulassung eines Arzneimittels. Das Schulungsmaterial soll diese ergänzen und klare Empfehlungen geben, wie sich Risiken für die Patienten beim Einsatz des jeweiligen Arzneimittels so weit wie möglich vermeiden lassen.
Frühe Nutzenbewertung
Pharmazeutische Unternehmen müssen bei der Markteinführung eines Arzneimittels mit neuem Wirkstoff oder bei einer Indikationserweiterung in einem Dossier unter anderem den medizinischen Zusatznutzen im Verhältnis zur zweckmäßigen Vergleichstherapie belegen.
Auf Grundlage des Dossiers veranlasst der G-BA eine Nutzenbewertung, die in der Regel spätestens drei Monate nach Einreichung der Nachweise (Dossier) vorzuliegen hat. Er kann die Nutzenbewertung selbst durchführen, aber auch das IQWiG oder Dritte damit beauftragen.
Im Nutzenbewertungsverfahren werden die Wahrscheinlichkeit und das Ausmaß des Zusatznutzens eines Wirkstoffs bzw. einer Wirkstoffkombination quantifiziert.
Kann kein Zusatznutzen im Vergleich zum Bestandsmarkt belegt werden, wird das neue Arzneimittel automatisch einer Festbetragsgruppe zugeordnet. Kommt der G-BA zu dem Ergebnis, dass ein Zusatznutzen belegt ist, handeln der GKV-Spitzenverband und der Hersteller einen Rabatt auf den bis dahin vom Hersteller selbst festgelegten Preis aus.
Vertragsärzte erhalten in der Verordnungssoftware einen Hinweis, wenn für ein Arzneimittel ein Beschluss zur frühen Nutzenbewertung vorliegt.
Die Mischpreisbildung für Arzneimittel, die in der frühen Nutzenbewertung des G-BA für bestimmte Patientengruppen einen Zusatznutzen zugesprochen bekommen haben, für andere dagegen nicht, ist rechtmäßig (BSG-Urteil 04.07.2018)
Der Beschluss bildet die Grundlage für die Verhandlungen zwischen pharmazeutischen Unternehmen und dem GKV-Spitzenverband über einen Erstattungsbetrag.
Der Erstattungsbetrag beeinflusst aber den Listenpreis des Medikaments nicht, sondern ist als Rabatt auf den Herstellerabgabepreis zu verstehen. Er gilt übrigens auch für die private Krankenversicherung und die Beihilfe.
Für alle Vereinbarungen, bei denen eine Anerkennung der Verordnung des Arzneimittels als Praxisbesonderheit nach vorgesehen ist, wurden folgende Anforderungen an Zweckmäßigkeit, Qualität und Wirtschaftlichkeit vereinbart.
Arzneimittel mit neuen Wirkstoffen, für die der G-BA eine frühe Nutzenbewertung nach § 35a SGB V bereits abgeschlossen hat, finden Sie wirkstoffbezogen und alphabetisch sortiert auf der G-BA-Website.
Medikationsplan
Patienten, die mindestens drei verordnete Medikamente anwenden, haben Anspruch auf einen Medikationsplan. Auf diesen Anspruch hat der Arzt seinen Patienten hinzuweisen.
Konkret besteht der Anspruch für Patienten, die gleichzeitig mindestensdrei verordnete - systemisch wirkende - Medikamente anwenden. Die Anwendung muss dauerhaft, also über einen Zeitraum von mindestens 28 Tagen, erfolgen.
Im Medikationsplan sollen die Patienten auf einen Blick sehen können, welche Medikamente sie einnehmen, was letztendlich zu mehr Sicherheit bei der Medikamenteneinnahme führen soll.
Es dürfen nur Medikationspläne mit Barcode/QR-Code ausgestellt werden, die den bundeseinheitlichen Vorgaben entsprechen. Für das erstmalige Erstellen eines Medikationsplans ist der Einsatz einer entsprechenden Software zwingend notwendig.
Um eine einheitliche Umsetzung in den Praxisverwaltungssystemen zu erreichen, sind die Softwareunternehmen verpflichtet, die Funktionalitäten zum Medikationsplan von der KBV zertifizieren zu lassen.
Seit Mitte 2020 kann der elektronische Medikationsplan (eMP), die digitale Weiterentwicklung des bundeseinheitlichen Medikationsplans, auf der eGK gespeichert werden. Die elektronische Speicherung der Medikationsdaten ist für den Patienten freiwillig. Den Anspruch auf die Papierversion hat er weiterhin.
Übersicht über die Arzneimittel eines Patienten
- die verordnungsfähigen Arzneimittel
- OTC- bzw. freiverkäufliche Arzneimittel
- ggf. Medizinprodukte (z. B. Abführmittel)
Angaben
- Wirkstoff
- Handelsnamen
- Stärke
- Darreichungsform
- Hinweise zur Dosierung
- Hinweise zur Anwendung
- Anwendungsgrund
Barcode
Zusätzlich ist ein optional nutzbarer Barcode auf dem Medikationsplan aufgebracht. Er enthält die Informationen des Plans in digitaler Form und ermöglicht, dass dieser unabhängig von der jeweiligen Praxis- oder Apothekensoftware per Scanner eingelesen und aktualisiert werden kann.
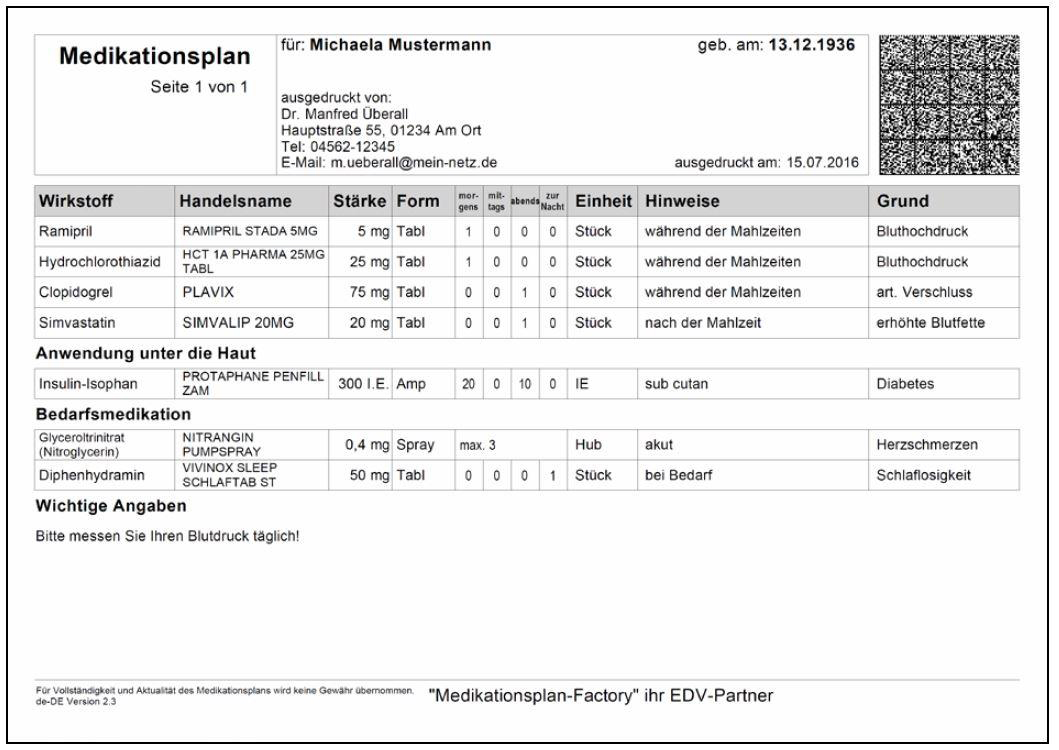
Beispiel eines Medikationsplans
Wirkstoffvereinbarung
Die Wirkstoffvereinbarung sorgt für Transparenz und somit Gerechtigkeit in der Arzneiverordnung. Zum ersten Mal besteht die Möglichkeit, durch bewusstes Verordnungsverhalten Ziele einzuhalten und somit die Regressgefahr auszusetzen.
Online-Service in "Meine KVB"
Die KVB informiert die Vertragsärzte quartalsweise mit einer praxisindividuellen Verordnungsstatistik ("Trendmeldung") über das Erreichen der vereinbarten Wirkstoffziele. Diese Verordnungsstatistik zeigt die erreichten Istwerte im Vergleich zu den Zielwerten.
Bitte nutzen Sie die Trendmeldung zur Steuerung Ihres Verordnungsverhaltens. Ausgebildete KVB-Beraterinnen und Berater helfen darüber hinaus gerne bei der Analyse und Bewertung Ihrer Daten.
Tipp: Die KVB kündigt jeder Trendmeldung mit einem separaten Anschreiben über das Nachrichtencenter in "Meine KVB" an.
In der Wirkstoffvereinbarung WSV 3.0 haben Rabattverträge an Bedeutung gewonnen. Mögliche Auswirkungen der Corona-Pandemie auf die Wirkstoffvereinbarung werden aufmerksam beobachtet. Mit den Krankenkassen als Vertragspartner der Wirkstoffvereinbarung steht die KVB in engem Austausch.
Bitte beachten für die Zielerreichung:
- Verordnen Sie weiter wie bisher Generika und Leitsubstanzen.
- Achten Sie bei der Verordnung von Generika und Leitsubstanzen zusätzlich auf bestehende Rabattverträge.
- Auch Altoriginale (kein Patentschutz mehr) mit Rabattvertrag wirken sich positiv aus und sogar patentgeschützte Originalpräparate mit Rabattvertrag tragen in geringem Maße zur Zielerreichung bei.
- Verzichten Sie wie gewohnt auf das Setzten von "aut idem" und behalten Sie sich dies für medizinisch begründeten Einzelfällen vor.
Generika- und Leitsubstanzziele
Bitte beachten: Die Zielausarbeitungen der Ziele 26.1, 26.2 und Ziel 22 werden derzeit überarbeitet.
Mitgliederportal "Meine KVB"
Über das KVB-Mitgliederportal können Sie in Ihrer Praxis und von außerhalb verschiedene Online-Services der KVB nutzen.